Interamerican Journal of Heath Sciences 4 (2024) - ISSN 2953-3724
DOI: 10.59471/ijhsc202498
Stimulation of cellular longevity using crispr-cas9 in aging-associated genes
Estimulación de la longevidad celular mediante el uso de crispr-cas9 en genes involucrados en el envejecimiento
María Fernanda Latorre Barragán1 * ![]() , Freddy
Raúl García Cárdenas1 *
, Freddy
Raúl García Cárdenas1 * ![]() , Marco
Vinicio Culqui Sánchez1 *
, Marco
Vinicio Culqui Sánchez1 * ![]()
1Universidad Regional Autónoma de Los Andes, Matriz Ambato, Ecuador.
![]()
Received: 12-11-2023 Revised: 16-02-2024 Accepted: 21-05-2024 Published: 22-05-2024
How to Cite: Latorre Barragán MF, García Cárdenas FR, Culqui Sánchez MV. Stimulation of cellular longevity using crispr-cas9 in aging-associated genes. Interamerican Journal of Health Sciences. 2024; 4:98. https://doi.org/10.59471/ijhsc202498
ABSTRACT
Cellular senescence is a natural process of all living organisms. The genetic bases of this process have allowed the recognition of genes whose expression has been related to longevity and cell aging. The genes KLOTHO, FOXO, and those associated with telomere maintenance are three examples of these. The development of gene editing techniques is being directed at genes of biomedical interest such as those mentioned above. This literature review presents discoveries made on the genetic manipulation of the KLOTHO, FOXO and genes associated with telomere maintenance using the CRISPR-CAS9 tool. As a result, it is reported that the reduction of the expression of these genes has resulted in the increase of processes that lead to rapid aging. On the contrary, its overexpression increases the maintenance of the chemical and biological balance in organisms both in vivo and in vitro. The development of the precision of advanced gene manipulation techniques seeks not only the study of new biochemical pathways but also possible applications in medicine focused on supporting the well-being of living organisms.
KEYWORDS
Cell Senescence, Cell Longevity, KLOTHO, FOXO, Genes Telomers, CRISPR-CAS9.
RESUMEN
El envejecimiento celular es un proceso natural de todo organismo vivo. Las bases genéticas de este proceso han permitido el reconocimiento de genes cuya expresión se ha relacionado a la longevidad y al envejecimiento celular. Los genes KLOTHO, FOXO y asociados a mantenimiento de los telómeros son tres ejemplos de estos. El desarrollo de las técnicas de edición génica está siendo dirigido a genes de interés biomédico como los antes nombrados. Esta revisión de literatura presenta descubrimientos realizados sobre la manipulación genética de los genes KLOTHO, FOXO y asociados a mantenimiento de los telómeros utilizando la herramienta CRISPR-CAS9. Como resultado se reporta que la reducción de la expresión de estos genes ha resultado en el incremento de procesos que conllevan a un rápido envejecimiento. Por lo contrario, su sobreexpresión incrementa el mantenimiento del balance químico y biológico en los organismos tanto in vivo como in vitro. El desarrollo de la precisión de técnicas avanzadas de manipulación génica procura no solo el estudio de nuevas rutas bioquímicas sino también posibles aplicaciones en la medicina enfocadas en apoyar el bienestar de los organismos vivos.
PALABRAS CLAVE
Envejecimiento Celular, Longevidad Celular, KLOTHO, FOXO, Genes Telómeros, CRISPR-CAS9.
INTRODUCCIÓN
El tiempo de vida de los organismos vivos es un rasgo de alta complejidad ya que depende tanto de rasgos heredables como del ambiente. El proceso de envejecimiento en organismos vivos presenta rasgos fenotípicos y genotípicos, los cuales pueden ser causados por factores ambientales (alimentación, contaminación, estrés, factores psicológicos, etc.) o genéticos.(1,2,3) El último puede darse como resultado de la disminución de la expresión de genes responsables de mantener las diferentes vías metabólicas como: la respiración celular, las vías de señalización de insulina, la regulación de las sirtuinas, los procesos antioxidantes, la homeostasis proteica, la cognición, la mielinización, etc.(4,5) Así, la generación de una o varias enfermedades dependerá de las vías genéticas alteradas.(6,7)
Existen genes cuya expresión se involucra directamente con el proceso de envejecimiento. Entre los más nombrados se encuentra el gen Klotho, el cual se transcribe en una proteína transmembrana presente principalmente en los riñones, cerebro y gónadas. Esta proteína está relacionada con la cognición, el funcionamiento neuronal, la defensa antioxidante, la mielinización y la prevención de enfermedades.(8,9,10,11)
FOXO, otro gen asociado a la longevidad se divide en FOXO1, FOXO3A, FOXO4, y FOXO6, los cuales funcionan como factores de transcripción. La presencia de estos factores es esencial para la expresión de genes que participan en vías bilógicas como: la resistencia al estrés oxidativo, metabolismo o control del ciclo celular.(3,12)
Por último, se encuentran los genes asociados a los telómeros, los cuales participan en la formación y mantenimiento de los telómeros junto a la nucleoproteína telomerasa. Los telómeros son estructuras que protegen a los genes de daño durante la replicación de los cromosomas. Sin embargo, estos se acortan a medida que la célula envejece, hasta que eventualmente, la célula pierde su capacidad de replicarse. Como resultado, se produce fallo en la función mitocondrial, aparición de cáncer e incluso el acortamiento de los telómeros, provocando senescencia celular.(13,14) La telomerasa es una nucleoproteína formada por ARN y una proteína que posee dos subunidades formadas por una transcriptasa inversa de la telomerasa humana (hTERT).(15) Esta última es la clave para el mantenimiento y síntesis de los telómeros.
Actualmente, se han desarrollado distintas herramientas de edición genética como las repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas asociadas a la enzima caspasa 9 (CRISPR-Cas9).(16) CRISPR-Cas9 utiliza un ARN guía para localizar una secuencia específica dentro del ADN objetivo, este se asocia a la proteína Cas9 para que realice una edición genética en las dos hebras del ADN.(11) Sin embargo, Cas9 ha sido mutada para realizar otras funciones diferentes a la edición, apareciendo así, la Cas9 muerta (del inglés death Cas9-dCas9) que puede utilizarse para reactivar o silenciar un gen. Por ejemplo, dCas9 puede transportar proteínas que estimulen o detengan la transcripción de uno o varios genes específicos.(17,18)
El desarrollo de las herramientas CRISPR-Cas9 y la manipulación de células madre pluripotentes inducidas (iPSCs), han permitido descubrir nuevas formas de terapia génica capaces de reactivar genes y contrarrestar los efectos del envejecimiento.(19) En el caso de los genes involucrados con en la longevidad como Klotho y FOXO, se han empleado estas herramientas para inducir su transcripción, sin provocar edición de sus nucleótidos.(3) De esta manera, se evita posibles efectos irreversibles a nivel genómico. Por ejemplo, experimentos in vitro e in vivo, realizados en células iPSCs y ratones respectivamente, han logrado desactivar la transcripción de Klotho y FOXO, evidenciando envejecimiento acelerado. Por otro lado, la sobreexpresión de los mismos, provocaron que los ratones manipulados vivan 30 % más que los ratones que no se sometieron a esta edición genética.(19) Así también, el sistema CRISPR-Ca9s en iPSCs permitió la manipulación del promotor hTERT, produciendo disfunción celular en el caso de la disminución de la expresión hTERT.(13)
En esta revisión bibliográfica, se describen los genes Klotho, FOXO y genes relacionados con la formación y mantenimiento de los telómeros y su rol en el proceso de envejecimiento y longevidad celular. Además, recopilamos información acerca de la implementación del sistema CRISPR-Cas9 para el estudio de los genes antes nombrados y su uso en terapias génicas dirigidas a prevenir o revertir el envejecimiento celular.
MÉTODO
La recolección de datos se realizó mediante la búsqueda en las bases de datos PubMed, Google Scholar y Web of Science. Los artículos citados fueron seleccionados de entre octubre de 2013 y febrero de 2023. Los criterios de búsqueda utilizados fueron “KLOTHO”, “FOXO”, “overexpression longevity genes”, “crispr on aging regulation”, “crispr and telomeres”. Bajo estos detalles, la búsqueda arrojó un total de 83 artículos publicados en inglés, de los cuales se revisaron 38. Los trabajos seleccionados están relacionados con la longevidad y el uso de herramientas CRISPR-Cas9 para la regulación de genes involucrados en procesos de envejecimiento. Las publicaciones que trataban de CRISPR, pero enfocados a temas no relacionados al envejecimiento fueron descartados.
RESULTADOS
CRISPR-Cas9 permite la manipulación genética
La técnica de manipulación genética CRISPR fue desarrollada a partir del sistema de reconocimiento y defensa de Streptococcus pyogenes.(20) Esta técnica permite la generación de cortes en una secuencia específica de la doble cadena de ADN. Para funcionar, CRISPR/Cas9 requiere de dos moléculas de ARN no codificable denominadas crARN (ARN CRISPR) y tracrARN (crARN transactivador); y una endonucleasa. La unión de estos elementos moleculares forma el complejo Cas9. El crARN y tracrARN conforman el ARNguia, el mismo que en un extremo posee una secuencia NGG (N= G, C, A o T) llamada motivo adyacente de protoespaciador (PAM).(21) El ARNguia dirige a la enzima Cas9 hasta la secuencia de ADN objetivo para que esta última realice un corte en las dos hebras.(16, 18) Esta técnica puede ser usada para realizar distintas ediciones genéticas, por ejemplo: disrupciones en la secuencia, deleciones o inserciones de nucleótidos, etiquetado molecular, entre otros (figura 1).(22)
Sin embargo, distintos grupos han trabajado en adecuar esta técnica para darle nuevos usos. Así, Feng Zhang desarrolló un sistema basado en CRIPR-Cas9 y obtuvo una enzima Cas9 incapaz de cortar la doble cadena de ADN, la cual es llamada Cas9 muerta (death Casp9 -dCas9-) (20). El sistema que utiliza dCas9 se denomina CRISPRi (CRISPR de interferencia).(23) La clave está en que dCas9 está ligada a factores de transcripción (efectores), represores y silenciadores, capaces de regular la transcripción de un gen específico o marcar un loci en particular para su estudio mediante fluorescencia. Sin embargo, dCas9 solo se activa cuando se incorpora los efectores y se desactiva en ausencia de estos.(18) A partir de aquí, se han llevado a cabo un sin número de investigaciones in vivo e in vitro para tratar enfermedades aparentemente sin cura o de índole genética (figura 2).(19,24,25,26,27)
Gen Klotho se expresa para proteger a la célula de daños
El gen KLOTHO se encuentra en el genoma de animales y humanos, su expresión produce una proteína transmembrana que posee el mismo nombre. La expresión de este gen interviene en distintas funciones del organismo como, por ejemplo: el control del estrés oxidativo, la cognición y el envejecimiento.(10)
Un estudio realizado en el 2016 encontró una asociación entre la expresión del gen KLOTHO con el incremento de la resistencia al estrés oxidativo (especies reactivas del oxígeno o ROS). ROS produce daños a nivel genómico, siendo el ADN mitocondrial más susceptible que el nuclear. Además, las sustancias oxidantes producen disfunción celular y alteración de diferentes vías de señalización molecular importantes para la homeostasis de la célula.(9,28,29) Los resultados de este estudio sugieren que este gen es capaz producir sustancias antioxidantes como: superóxido dismutasa, glutatión y catalasa, contrarrestando el envejecimiento celular al aplacar las sustancias oxidantes antes que produzcan algún tipo de daño.(9)
La función más estudiada de Klotho es su rol en el envejecimiento celular. Aquí, la evidencia apunta que la expresión de este gen es óptima después del nacimiento, pero va disminuyendo con la edad. Para demostrarlo se han llevado a cabo varios estudios científicos. Por ejemplo, experimentos in vivo, realizados en ratones, ratas y monos Rhesus asocian el decremento de la expresión del gen Klotho con el envejecimiento celular.(9) Por otro lado, la sobreexpresión de Klotho en ratones, resultó en un incremento del tiempo de vida de los mismos. Este experimento se enfocó en manipular el gen Klotho usando la técnica CRISPR-Cas9 en modelo murino.(10) Como resultado se observó que el tiempo de vida de estos ratones se extendió en un 30 %.(10) Por lo contrario, el knockout genético (KO) en el mismo gen, resultó en fenotipos de envejecimiento acelerado y prematuro, demostrando signos similares a los que se presentan en personas de edades avanzadas.(11) Estos resultados proponen que la sobreexpresión del gen Klotho tiene el potencial de restaurar mecanismos celulares en que se pierden con la edad y, de esta manera, devolver la funcionalidad óptima del organismo manipulado.
El gen FOXO es esencial para llevar a cabo la transcripción de otros genes
El gen FOXO transcribe un conjunto de factores de transcripción que permiten la expresión de diferentes genes, por lo cual, está involucrado en varios procesos celulares. Por ejemplo, el factor FOXO3A está involucrado con la longevidad de moscas, gusanos y mamíferos.(12) De hecho, este es el factor más replicado dentro de los factores relacionados con la longevidad. La expresión y regulación de este gen es de suma importancia a nivel celular, a pesar de esto, los polimorfismos dentro de su secuencia afectan las funciones de FOXO3A y, potencialmente, la desregulación de la cascada genética.(3)
Para demostrar su importancia a nivel celular, un experimento in vivo realizado en ratones llevó a cabo un KO genético en los factores FOXO1, 3 y 4, dando como resultado el desarrollo de células cancerígenas y acelerando el proceso de envejecimiento. Esto significa que la disminución de la traducción de las proteínas FOXO, inactiva el control de proliferación celular en tumores cancerosos humanos.(3)
Otro rol que le ha sido atribuido al gen FOXO es la prolongación de vida del organismo dado a la respuesta que promueve frente a ROS. Teniendo en cuenta que ROS estimula la aparición de enfermedades, los mecanismos de FOXO previenen dichas enfermedades por la producción se sustancias antioxidantes y de esta manera induciendo a la homeostasis de ROS en las células.(4)
Por otro lado, FOXO6 es mayormente expresado en el cerebro, permitiendo un manteamiento de las funciones cognitivas. La generación de un FOXO6 KO en ratones, resultó en la aparición de enfermedades neurodegenerativas y acortó el tiempo de vida de los individuos.(4,6)
Los Telómeros y las telomerasas garantizan una correcta división celular
Los telómeros son material genético de secuencia repetitiva que se encuentran a los extremos de los cromosomas. Estos juegan un papel importante en la longevidad, debido a que, de estos dependen la replicación celular y la integridad del ADN, prolongando la vida útil de un individuo. Después del nacimiento, los telómeros son mantenidos por una nucleoproteína llamada telomerasa. Esta es capaz de proteger el material genético y garantizar la integridad de los genes y su expresión. Sin embargo, la expresión de la telomerasa disminuye con la edad del individuo, lo cual resulta en la reducción de los telómeros.(1,10,13)
La telomerasa transcriptasa inversa humana (hTERT) es la subunidad de la telomerasa de más importancia para el mantenimiento de los telómeros. De hecho, su sobreexpresión incrementa la proliferación celular. Por otro lado, la disminución en la expresión de hTERT reduce la capacidad replicativa, la resistencia al estrés oxidativo y la pluripotencialidad en iPSC.(15)
Un estudio reportó que la remoción de los telómeros de células humanas resultó en disfunción mitocondrial y aparición de proteínas asociadas a la enfermedad de Parkinson.(1,10,13) Por lo contrario, la inducción de la expresión de hTERT, promovió la elongación de los telómeros y se contrarrestó, hasta cierto grado, la replicación y crecimiento de las células cancerígenas.(13,14)
Edición del genoma y utilidad clínica
La implementación clínica de las técnicas de modificación genómica en el contexto de la terapia biológica ha surgido como una consecuencia natural de la necesidad de tratar las anomalías genéticas que originan fenotipos específicos. La corrección del material genético ha engendrado un conocimiento sustancial en cuanto a los mecanismos operativos de numerosas herramientas preeminentes para la modificación genómica, la parte más desafiante y menos predecible de la indagación radica en la capacidad de manipular el genoma de células humanas en su estado vital, donde se requiere una enmienda con gran precisión. La evaluación de las perspectivas que ostentan las tecnologías de edición genómica en el contexto del tratamiento de enfermedades, así como la ulterior evolución de la “terapia basada en edición genómica”, están intrínsecamente ligadas a la comprensión de las terapias biológicas actuales, englobando las herramientas de modificación genómica. Destacan técnicas como la terapia con células madre, oligonucleótidos de ARN, nucleasas programables y el desarrollo de de estrategias para mejorar los mecanismos de reparación. Los beneficios directos en el campo clínico pueden ser objetivos en los trastornos infecciosos al eliminar la secuencia del genoma viral, en el tratamiento de tumores malignos mediante la terapia con células CAR-T y la intervención en enfermedades hereditarias. El retraso en la longevidad mediante las distintas técnicas podría beneficiar también en la prevención de enfermedades crónicas no transmisibles.

Figura 1. Mecanismo de CRISPR-Cas9 para editar el ADN en un punto específico
Fuente: Modificado de (Doudna & Charpentier, 2014).
La técnica CRISPR-Cas9 requiere de una endonucleasa combinada con un crARN y un tracrARN, que en conjunto se los denomina ARN guía. El ARN guía posee aproximadamente 20 nucleótidos complementarios al ADN objetivo y en un extremo posee la secuencia PAM. La unión de estos elementos moleculares forma el complejo Cas9. Para llevar a cabo la edición, el ARN guía, se dirige hasta la secuencia complementaria en el ADN objetivo, formando un bucle-R. Es aquí cuando la endonucleasa produce un corte doble de las hebras en el sitio específico, produciendo una ruptura del ADN. Finamente, los mecanismos de reparación se encargan de sellar los enlaces de la molécula de ADN, lo cual introduce ediciones en la secuencia objetivo.(16,20,21)
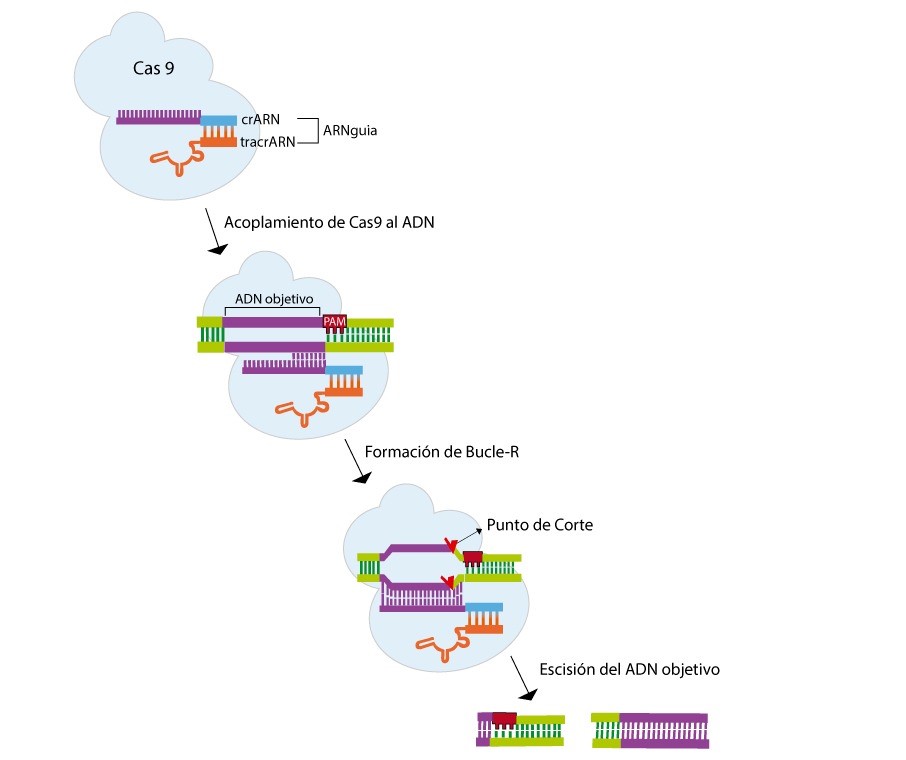
Figura 2. Mecanismo de funcionamiento de CRISPRi para controlar la actividad genética
Fuente: Modificado de (Richter, 2017).
El sistema CRISPRi tiene el mismo principio que el CRISPR-Cas9 antes explicado, con la única diferencia que la endonucleasa del conjunto es catalíticamente inactiva, lo cual le da el nombre de death Cas9 (dCas9). Este proceso inicia con el ensamblaje de la endonucleasa para luego combinarse con un ARN guía formando dCas9 guiada. Esta endonucleasa se convierte en un factor epigenético regulador de la transcripción cuando incorpora efectores.(23)
DISCUSIÓN
Esta revisión científica se ha enfocado en describir las funciones del gen Klotho, FOXO y los telómeros en el envejecimiento celular. Además, se ha investigado el uso de las herramientas CRISPR-Cas9 para la regulación transcripcional de estos genes y su aplicación en terapias génicas en humanos para revertir los efectos del envejecimiento.
El gen Klotho estimula la funcionalidad de las células involucradas en la cognición, resistencia antioxidante y otras vías biológicas importantes para la función celular.(30) Por su parte, el gen FOXO es un factor fundamental para la expresión de genes encargados de contrarrestar los efectos producidos por la edad.(31,32) Por último, los telómeros y la telomerasa están a cargo de proteger el material genético. De hecho, los daños en estas estructuras conllevan a la incapacidad de la replicación celular y eventualmente a la muerte celular.(33,34) El desarrollo de técnicas de manipulación genética, como CRISPR-Cas9, han permitido conocer más a profundidad el rol de estos genes. Así, la sobreexpresión de Klotho, FOXO y los telómeros han resultado en la mitigación de patologías y fenotipos producidos por la edad, de esta forma la extensión del tiempo vida.
La evidencia científica, señala que los genes Klotho, FOXO y genes relacionados con la formación y mantenimiento de los telómeros, desempeñan un rol determinante en el proceso de envejecimiento y longevidad. Sin embargo, estos genes dejan de expresarse a medida que el organismo envejece, evidenciando que el bienestar de biológico de un organismo depende de la expresión de los genes mencionados anteriormente. Es por esta razón que deben ser sometidos a una reactivación de su expresión para restaurar la homeostasis mediante edición genética. La eficacia de las herramientas genéticas ha sido demostrada en gran cantidad de estudios in vivo e in vitro, lo cual alienta al desarrollo de terapias génicas para contrarrestar los efectos de la pérdida de expresión de estos genes.(8,13,14,16,19,20,35,36,37)
En el futuro se espera desarrollar terapias genéticas enfocadas a revertir el envejecimiento celular y prolongar la vida del organismo. A esto, hay que añadir el aporte que brinda la implementación de ratones avatar,(38) los cuales permiten reproducir los fenotipos de envejecimiento humanos y, una vez tratada la patología, trasladar el tratamiento a dichas personas. Es por ello que, a mediano plazo, la ciencia permitirá la producción de terapias especializadas en cada individuo.
Finalmente, es importante sugerir la generación de más estudios enfocados en el desarrollo de terapia génica dirigida por herramientas como el CRISPR-Cas9, para, de esta forma, conseguir contrarrestar los efectos de enfermedades degenerativas causadas por la edad.
CONCLUSIONES
· El gen Klotho es un gen clave en el desempeño cognitivo y la resistencia antioxidante. En edades avanzadas, el declive de la expresión de este gen provoca el desarrollo de enfermedades neuro degenerativas y daños celulares.
· Existen una gran variedad de genes involucrados en diferentes vías biológicas como, control y homeostasis celular, los mismos que dependen del gen FOXO. De hecho, la reducción de la longevidad es provocada por un déficit de la expresión de FOXO, lo que resulta en el silenciamiento genético y a disfuncionalidad celular progresiva.
· El paso del tiempo produce la reducción de los telómeros, lo cual afecta directamente a la protección del material genético. En el punto en que los genes ya no son capaces de traducir telomerasa, los telómeros dejan de recibir mantenimiento por dicha proteína. Como resultado, la vida celular se acorta dado a que la célula no es capaz de dividirse. En muchos casos, el daño del ADN genera falta de control en la replicación de las células, produciendo cáncer y dejando de ser útil para el funcionamiento del organismo.
· La aparición de las herramientas de edición genética CRISPR-Cas9 ha traído consigo nuevas oportunidades de tratamientos. Uno de los usos prometedores está enfocado en tratar los genotipos del envejecimiento e implementar terapias génicas en un futuro no muy lejano. Estas herramientas permitirán dar un paso importante en la medicina, permitiendo crear terapias especializadas dirigidas a problemas que, hasta hoy, son difíciles de tratar.
REFERENCIAS
1. Lau C-H, Suh Y. Genome and epigenome editing in mechanistic studies of human aging and aging-related disease. Gerontology. 2017;63(2):103-17.
2. Petr MA, Tulika T, Carmona-Marin LM, Scheibye-Knudsen M. Protecting the Aging Genome. Trends Cell Biol. 2020;30(2):117-32.
3. Link W. Introduction to FOXO Biology. Methods Mol Biol. 2019;1890:1-9.
4. Martins R, Lithgow GJ, Link W. Long live FOXO: unraveling the role of FOXO proteins in aging and longevity. Aging Cell. 2016;15(2):196-207.
5. Sutphin GL, Korstanje R. Chapter 1 - Longevity as a Complex Genetic Trait. In: Kaeberlein MR, Martin GM, editors. Handbook of the Biology of Aging (Eighth Edition). San Diego: Academic Press; 2016. p. 3-54.
6. Booth LN, Brunet A. The Aging Epigenome. Mol Cell. 2016;62(5):728-44.
7. Sun X, Chen WD, Wang YD. DAF-16/FOXO Transcription Factor in Aging and Longevity. Front Pharmacol. 2017;8:548.
8. Miano JM, Long X. CRISPR-tagging mice in aging research. Aging (Albany NY). 2018;10(9):2226-7.
9. Abraham C, Mullen P, Tucker-Zhou T, Chen C, Zeldich E. Klotho is a neuroprotective and cognition-enhancing protein. Vitamins & Hormones. 101: Elsevier; 2016. p. 215-38.
10. Cheikhi A, Barchowsky A, Sahu A, Shinde SN, Pius A, Clemens ZJ, et al. Klotho: An Elephant in Aging Research. J Gerontol A Biol Sci Med Sci. 2019;74(7):1031-42.
11. Chen CD, Zeldich E, Li Y, Yuste A, Abraham CR. Activation of the Anti-Aging and Cognition-Enhancing Gene Klotho by CRISPR-dCas9 Transcriptional Effector Complex. J Mol Neurosci. 2018;64(2):175-84.
12. Murtaza G, Khan AK, Rashid R, Muneer S, Hasan SMF, Chen J. FOXO Transcriptional Factors and Long-Term Living. Oxid Med Cell Longev. 2017;2017:3494289.
13. Brane AC, Tollefsbol TO. Targeting Telomeres and Telomerase: Studies in Aging and Disease Utilizing CRISPR/Cas9 Technology. Cells. 2019;8(2).
14. Kim H, Ham S, Jo M, Lee GH, Lee YS, Shin JH, et al. CRISPR-Cas9 Mediated Telomere Removal Leads to Mitochondrial Stress and Protein Aggregation. Int J Mol Sci. 2017;18(10).
15. Wu RA, Upton HE, Vogan JM, Collins K. Telomerase Mechanism of Telomere Synthesis. Annu Rev Biochem. 2017;86:439-60.
16. Doudna JA, Charpentier E. Genome editing. The new frontier of genome engineering with CRISPR-Cas9. Science. 2014;346(6213):1258096.
17. Boyle EA, Andreasson JOL, Chircus LM, Sternberg SH, Wu MJ, Guegler CK, et al. High-throughput biochemical profiling reveals sequence determinants of dCas9 off-target binding and unbinding. Proc Natl Acad Sci U S A. 2017;114(21):5461-6.
18. Richter F, Fonfara I, Gelfert R, Nack J, Charpentier E, Moglich A. Switchable Cas9. Curr Opin Biotechnol. 2017;48:119-26.
19. Acun A, Zorlutuna P. CRISPR/Cas9 edited hiPSC-based vascular tissues to model aging and disease-dependent impairment. Tissue Engineering Part A. 2019;25.
20. Montoliu L. Editando genes: recorta, pega y colorea: las maravillosas herramientas CRISPR: Next Door Publishers SL; 2019.
21. Ran FA, Hsu PD, Wright J, Agarwala V, Scott DA, Zhang F. Genome engineering using the CRISPR-Cas9 system. Nature protocols. 2013;8(11):2281-308.
22. Barrangou R, Birmingham A, Wiemann S, Beijersbergen RL, Hornung V, Smith Anja vB. Advances in CRISPR-Cas9 genome engineering: lessons learned from RNA interference. Nucleic Acids Research. 2015;43(7):3407-19.
23. Larson MH, Gilbert LA, Wang X, Lim WA, Weissman JS, Qi LS. CRISPR interference (CRISPRi) for sequence-specific control of gene expression. Nature protocols. 2013;8(11):2180-96.
24. Bengtsson NE, Hall JK, Odom GL, Phelps MP, Andrus CR, Hawkins RD, et al. Muscle-specific CRISPR/Cas9 dystrophin gene editing ameliorates pathophysiology in a mouse model for Duchenne muscular dystrophy. Nature communications. 2017;8(1):1-10.
25. Safari F, Farajnia S, Arya M, Zarredar H, Nasrolahi A. CRISPR and personalized Treg therapy: new insights into the treatment of rheumatoid arthritis. Immunopharmacology and immunotoxicology. 2018;40(3):201-11.
26. Wang H-X, Li M, Lee CM, Chakraborty S, Kim H-W, Bao G, et al. CRISPR/Cas9-based genome editing for disease modeling and therapy: challenges and opportunities for nonviral delivery. Chemical reviews. 2017;117(15):9874-906.
27. Liu J, Zhou Y, Qi X, Chen J, Chen W, Qiu G, et al. CRISPR/Cas9 in zebrafish: an efficient combination for human genetic diseases modeling. Human genetics. 2017;136(1):1-12.
28. Aitken RJ. Reactive oxygen species as mediators of sperm capacitation and pathological damage. Molecular reproduction and development. 2017;84(10):1039-52.
29. Dutta EH, Behnia F, Boldogh I, Saade GR, Taylor BD, Kacerovský M, et al. Oxidative stress damage-associated molecular signaling pathways differentiate spontaneous preterm birth and preterm premature rupture of the membranes. Mhr: Basic science of reproductive medicine. 2016;22(2):143-57.
30. Quarles LD. FGF-23 and α-Klotho Co-Dependent and Independent Functions. Current opinion in nephrology and hypertension. 2019;28(1):16.
31. Tia N, Singh AK, Pandey P, Azad CS, Chaudhary P, Gambhir IS. Role of Forkhead Box O (FOXO) transcription factor in aging and diseases. Gene. 2018;648:97-105.
32. Artoni F, Kreipke RE, Palmeira O, Dixon C, Goldberg Z, Ruohola-Baker H. Loss of foxo rescues stem cell aging in Drosophila germ line. Elife. 2017;6:e27842.
33. Østhus IBØ, Sgura A, Berardinelli F, Vatten Alsnes I, Brønstad E, Rehn T, et al. La Longitud de los Telómeros y el Ejercicio de Resistencia de Larga Duración:¿ El Entrenamiento Afecta la Edad Biológica? Un Estudio Piloto-Ciencias del Ejercicio. PubliCE. 2016.
34. Shay JW. Telomeres and aging. Current Opinion in Cell Biology. 2018;52:1-7.
35. Wang S, Min Z, Ji Q, Geng L, Su Y, Liu Z, et al. Rescue of premature aging defects in Cockayne syndrome stem cells by CRISPR/Cas9-mediated gene correction. Protein & cell. 2020;11(1):1-22.
36. Shih G. Using CRISPR/dCas9 to Dissect the Role of Ribosomal DNA in Cellular Growth and Aging in Saccharomyces cerevisiae: University of California–San Diego; 2018.
37. Caobi A, Dutta RK, Garbinski LD, Esteban-Lopez M, Ceyhan Y, Andre M, et al. The Impact of CRISPR-Cas9 on Age-related Disorders: From Pathology to Therapy. Aging and disease. 2020:0.
38. Ilmer M, Berger M. Avatars to personalized medicine: of mice and men. Hepatobiliary Surg Nutr. 2017;6(5):347-9.
FINANCIACIÓN
No se recibió financiación para el desarrollo del presente artículo.
CONFLICTOS DE INTERESES
Los autores declaran que no existen conflictos de intereses.
CONTRIBUCIÓN DE LOS AUTORÍA
Conceptualización: María Fernanda Latorre Barragán, Freddy Raúl García Cárdenas, Marco Vinicio Culqui Sánchez.
Supervisión: María Fernanda Latorre Barragán, Freddy Raúl García Cárdenas, Marco Vinicio Culqui Sánchez.
Metodología: María Fernanda Latorre Barragán, Freddy Raúl García Cárdenas, Marco Vinicio Culqui Sánchez.
Análisis formal: María Fernanda Latorre Barragán, Freddy Raúl García Cárdenas, Marco Vinicio Culqui Sánchez.
Recursos: María Fernanda Latorre Barragán, Freddy Raúl García Cárdenas, Marco Vinicio Culqui Sánchez.
Curación de datos: María Fernanda Latorre Barragán, Freddy Raúl García Cárdenas, Marco Vinicio Culqui Sánchez.
Redacción - borrador original: María Fernanda Latorre Barragán, Freddy Raúl García Cárdenas, Marco Vinicio Culqui Sánchez.
Redacción - revisión y edición: María Fernanda Latorre Barragán, Freddy Raúl García Cárdenas, Marco Vinicio Culqui Sánchez.